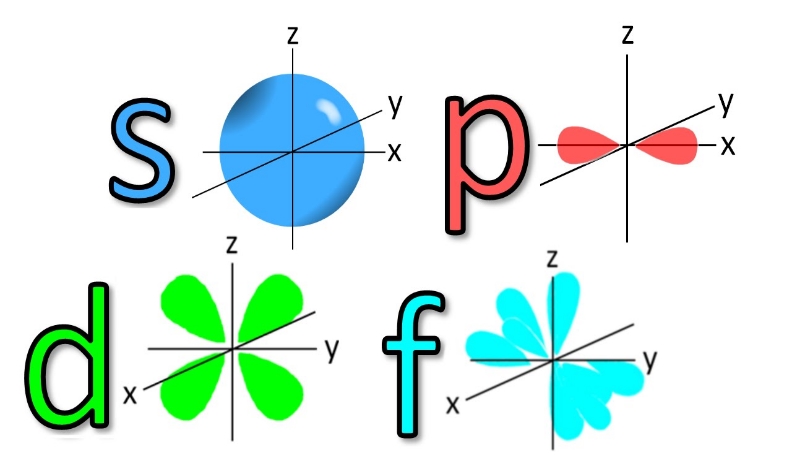به نام خدا
در این مطلب به بررسی چهار عدد کوانتومیاصلی و فرعی و مغناطیسی و اسپین، همچنین اوربیتالها، اصل
طرد پائولی و همچنین توضیح علمینحوه عمل ابر رساناها اشاره میکنیم.
امیدوارم مفید واقع بشه.


سه قاعده اصل
طرد پائولی، قاعده هوند، قاعده آفبا نحوه قرار گیری الکترونها در مدار اتمها را بررسی میکند.
برای درک مفهوم اصل
طرد پائولی ابتدا باید انواع اعداد کوانتومیکه به نوعی تعیین کننده حالتهای مختلف یک الکترون هستند بشناسیم، در ادامه به بررسی آنها میپردازیم.
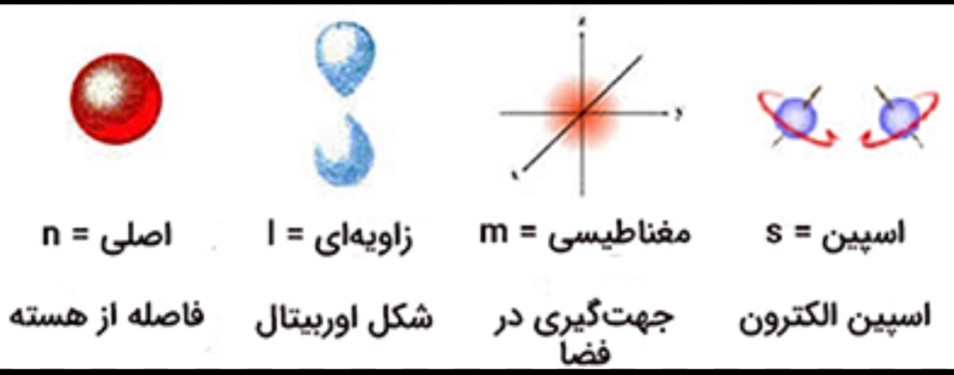
عدد
کوانتومی
اصلی(n)
عدد کوانتومیاصلی بیان کننده سطح انرژی و فاصله از هسته الکترون هست، هر چه عدد n بزرگتر، سطح انرژی بالاتر و فاصله از هسته بیشتر است،الکترونها با جذب انرژی به سطوح بالاتر و با نشر انرژی به سطوح پایین تر میرن.
عدد کوانتومیفرعی(l)
عدد کوانتومیفرعی بیان کننده شکل اوربیتال هست، l در کمترین حالت 0 است، مقدار l به مقدار n بستگی داره به صورتی که مقدار l میتونه از 0 تا n-1 باشه، مثلا برای لایه الکترونی با n=2، عدد کوانتومیفرعی برابر 0,1 هست، شکل اوربیتالها و اسامیاونا رو میتونید تو تصویر زیر ببینید.
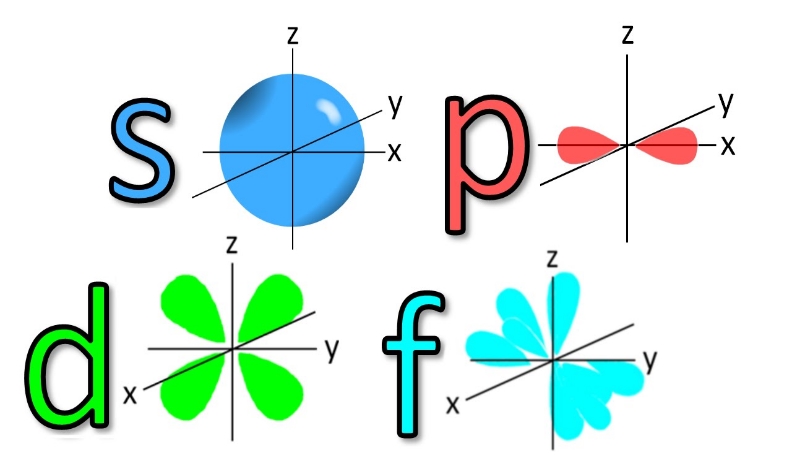
| l |
نام زیر لایه |
| 0
|
s |
| 1 |
p |
| 2 |
d |
| 3 |
f |
عدد کوانتومیمغناطیسی(m)
عدد کوانتومیمغناطیسی تعیین کننده تعداد اوربیتالها مخصوص هر عدد کوانتومیفرعی هست، که این عدد برای هر زیرلایه با l، از منفی l تا مثبت l موجوده
مثلا برای زیر لایه p با عدد کوانتومیفرعی 1،عدد کوانتومیمغناطیسی برابر1,0,1- هست که هر کدام زاویه قرار گیری متفاوتی دارند، در هر کدام از این اوربیتالها دو الکترون با اسپین متفاوت قرار میگیرند.
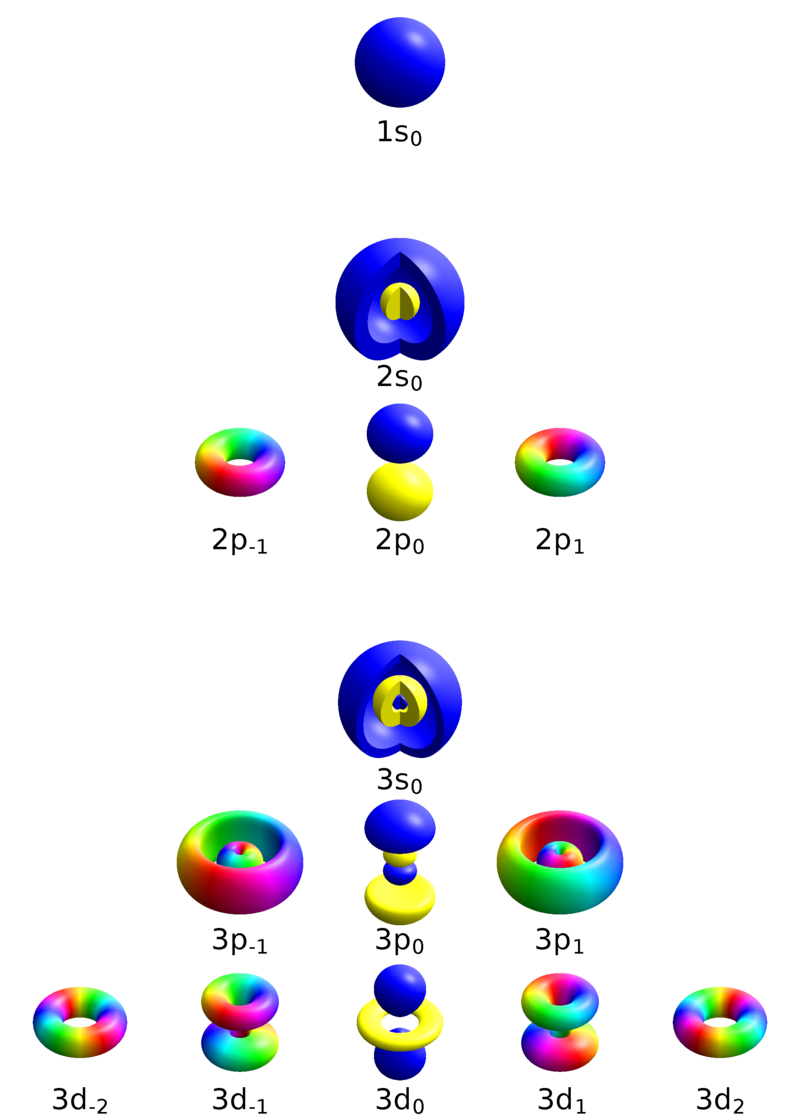
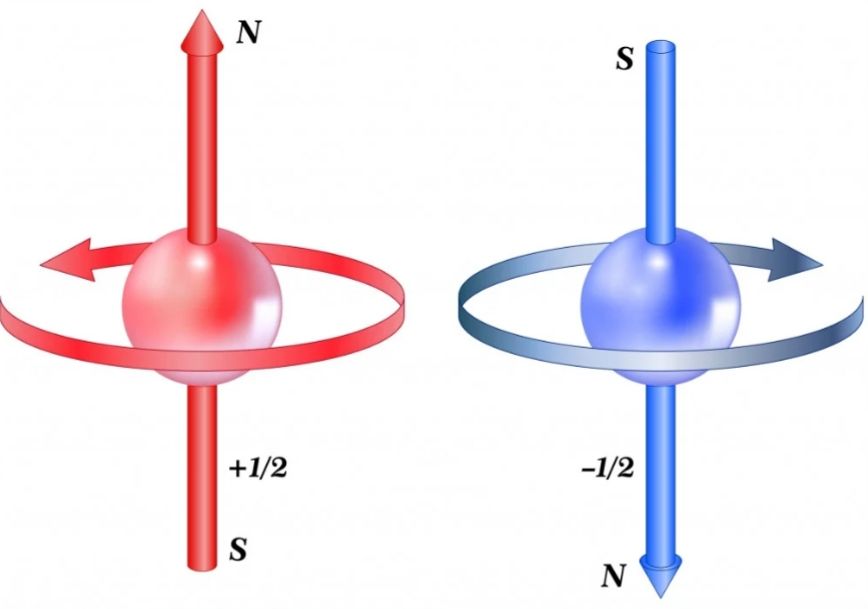
عدد کوانتومیاسپین(s)
برای هر الکترون در یک اوربیتال دو حالت اسپین وجود دارد، اسپین در حالت تصور به صورت چرخش الکترون لحاظ میشود که دو حالت بالا و پایین دارد. برای فرمیونها عدد کوانتومیاسپین عدد کسری هست و عدد صحیح نیست اما برای بوزونها این عدد کوانتومیعدد صحیحه.

اصل
طرد پائولی
این اصل به طور خلاصه بیان میکنه هیچ فرمیونی(به مطلب قبلی مراجعه شود) که نمونه مهم آن الکترون هست، نمیتونه همزمان این اعداد کوانتومیرو به صورت برابر داشته باشه، یعنی برای مثال در یک اتم در لایه شماره دو و زیر لایه p منفی 1 با اسپین بالا تنها یک الکترون میتونه قرار بگیره و الکترون دیگه از این حالت طرد میشه.
یعنی به طور ساده و خلاصه، هیچ دو الکترونی نمیتونن یه جا باشن(:
برخلاف بوزونها که میتونن تو یه جا باشن
ابر رسانا
یکی از پیشرفتهای مهم علمیچند سال اخیر کشف ابررساناها هست که نقش مهمیدر بازار تکنولوژی آینده خواهد داشت، در این مطلب به بیان کاربردهای اون نمیپردارم صرفا مطلب علمیاونو بررسی میکنم،
همونطور که اشاره شد الکترونها نمیتونن همزمان یه جا تصاحب کنن برای همین وقتی توی یک رسانا حرکت میکنن دچار محدودیت میشن، اما در رساناها به صورت موقت دو الکترون در کنار هم قرار گرفته و جفت کوپر رو تشکیل میدن که در این صورت با جمع دو اسپین کسری، یک اسپین صحیح تشکیل میشود و خواص جفت کوپر را شبیه خواص بوزونها میکند که از اصل
طرد پائولی پیروی نمیکنند اما این جفتهای کوپر به علت نوسانات حاصل از دمای جسم سریعا از بین میرن، در بعضی از فلزات با نزدیک کردن دمای جسم به صفر مطلق یا همون منفی دویست و هفتاد و سه درجه سانتی گراد، قبل از رسیدن به صفر مطلق، جفتهای کوپر توانایی تشکیل پیدا میکنند و در این صورت الکترونها بدون هیچ مانعی توانایی عبور از رسانا دارند، در این حالت رسانایی جسم به بینهایت میرسه و به جسم ابررسانا میگویند
امیدوارم این مقاله مفید واقع بشه براتون
نظراتتون رو با ما به اشتراک بزارید.